江蘇NDAeCTD推薦
歐美eCTD實施經驗豐富,中國可借鑒以加速進程。中國可能會經歷從企業自愿eCTD提交到強制eCTD提交的過渡,且將緊隨ICH步伐,尤其在CMC資料整理方面。全球正向eCTD 4.0過渡,中國也不例外,將隨日本、歐盟、美國等強制實施而逐步推進。 中國崛起帶來全球化競爭機會,eCTD實施將助力中國企業走向世界。技術進步將加速eCTD實施,企業需密切關注技術動態,調整戰略。隨著國內就業壓力增大和企業出海需求增加,了解eCTD等國際標準將成為職業發展的重要競爭力。 中國推進eCTD需面對特色問題,如上市后申請資料匹配,需企業與監管機構共同解決。基線要求是關鍵,中國需制定適合國情的要求。期待未來執行指南既具特色又與國際接軌,為eCTD實施提供支持。瑞士NDA注冊申報相關技術支持。江蘇NDAeCTD推薦
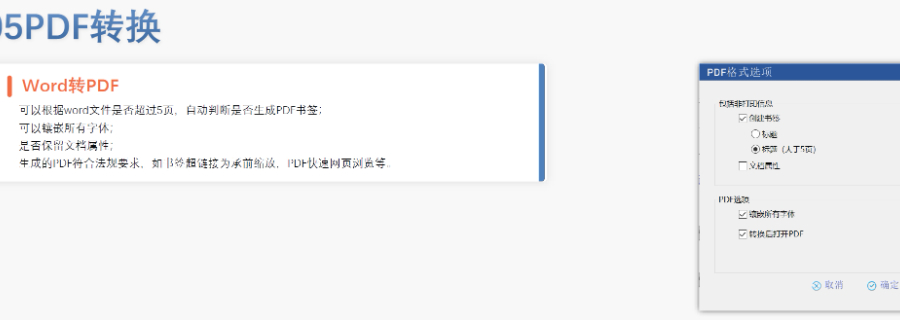
電子簽章與安全性 FDA要求所有PDF文件需經數字簽名,并通過MD5校驗確保傳輸完整性。簽章需符合21 CFR Part 11的電子記錄規范,部分情況下允許臨時放寬(如期間的遠程簽署)。 ?多模塊協同驗證 模塊1(行政文件)的區域性元數據(如申請類型、聯系人信息)需與模塊2-5的內容邏輯一致。例如,生物制品的3.2.R擴展節點命名需遵循特定規則,而化學藥品則禁止使用此類擴展。 ?驗證工具與流程 主流工具如LORENZ eValidator支持自動化驗證,生成包含錯誤定位與修復建議的詳細報告。企業需在提交前完成內部驗證,并通過“藥品業務應用系統”推送受理狀態。 ?常見問題與規避策略 高頻錯誤包括PDF安全設置、書簽鏈接失效、STF(研究標簽文件)缺失等。例如,未在5.3.1章節標注研究ID會導致驗證警告,需通過說明函解釋。企業可通過建立標準化模板庫和預檢流程降低風險。 ?后續監管與更 FDA定期更驗證標準(如2022年增臨床試驗數據完整性檢查),企業需通過訂閱官方通知或第三方服務商獲取動態蕪湖ANDAeCTD推薦瑞士eCTD申報軟件相關技術支持。
eCTD在歐盟藥品監管中的歷史背景:歐盟eCTD(電子通用技術文檔)的發展始于對臨床試驗和藥品審評流程標準化的需求。2001年,歐盟引入《臨床試驗指令》(CTD)作為統一的法律框架,但其分散的成員國申報機制導致效率低下。2014年,歐盟通過《臨床試驗法規》(CTR, Regulation EU No. 536/2014),要求通過CTIS平臺(臨床試驗信息系統)集中提交臨床試驗申請(CTA),并逐步推動eCTD作為電子化申報的工具。這一旨在解決傳統CTD模式下審評周期長、多國協調成本高的問題,為eCTD的實施奠定了基礎。
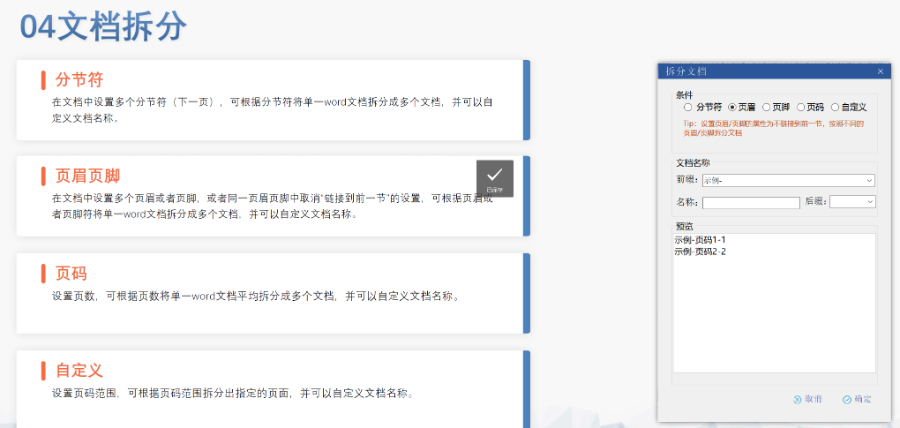
eCTD生命周期管理與變更提交:歐盟要求eCTD申報資料覆蓋藥品全生命周期,包括提交、補充申請及實質性變更。例如,增成員國需提交“附加成員國序列”,審評時間約52-83天;重大變更(如生產工藝調整)需創建序列并通過CTIS平臺更模塊3和模塊1的GMP證明。技術驗證工具(如EDQM推薦的檢查軟件)需在每次提交前運行,確保XML骨架文件與PDF書簽層級符合規范。此外,電子簽章需符合《歐盟電子簽名法》,并在模塊1中明確標注法律效力。歐洲通用提交門戶(Common European Submission Portal,CESP)是歐盟及成員國藥品監管機構間用于電子化提交申報資料的重要平臺。以下是關于CESP的詳細介紹: CESP是由歐盟藥品監管部門負責人網絡(HMA)合作開發的在線交付系統,旨在為藥品注冊申請者、利益相關方和監管機構之間提供統一、安全的電子提交通道。其設計初衷是簡化跨國申報流程,允許通過單一門戶向多個歐洲國家的藥監部門同時提交申請,避免了重復操作。瑞士DMF注冊申報相關技術支持。
美國eCTD的強制實施時間與范圍:美國自2017年5月5日起要求藥申請(NDA)、仿制藥申請(ANDA)和生物制品許可申請(BLA)必須通過eCTD格式提交,2018年5月5日進一步擴展至臨床試驗申請(IND)和藥品主文件(DMF)。FDA通過《聯邦食品、藥品和化妝品法案》第745A條明確電子提交的強制性,豁免非商業化IND和部分DMF類型(如Ⅲ類)。2023年數據顯示,FDA接收的eCTD申請占比已達92%,標志著電子化審評體系的成熟。企業若未按規范提交(如缺少文件或重復序列號),將直接被拒收。歐盟eCTD申報軟件相關技術支持。浙江中國eCTD系統
美國eCTD申報軟件相關技術支持。江蘇NDAeCTD推薦
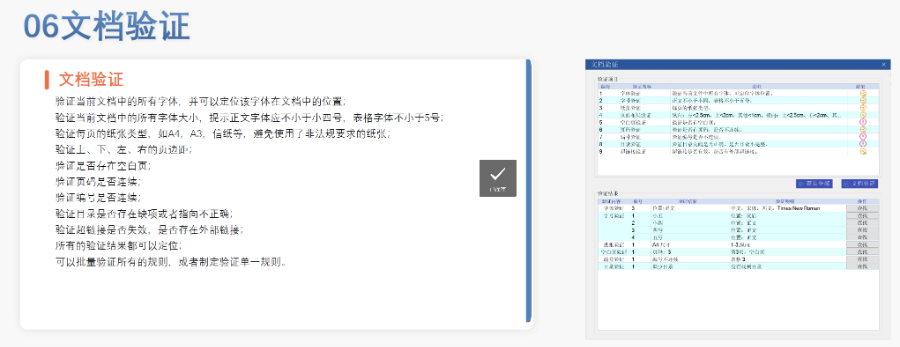
歐盟eCTD的歷史沿革與強制實施 歐盟自2003年逐步推進eCTD(電子通用技術文檔)的標準化進程,初要求藥注冊申請(MAA)采用CTD格式。2010年,集中審評程序(CP)率先強制使用eCTD,隨后分散程序(DCP)和互認程序(MRP)分別于2015年、2017年跟進。至2019年,歐盟要求所有國家程序(NP)的注冊申請均以eCTD格式提交,標志著其電子遞交體系的成熟。2024年,EMA啟動eCTD4.0試點項目,旨在提升技術兼容性與審評效率。 eCTD驗證標準的迭代與關鍵更 歐盟的驗證標準歷經多次調整,例如2025年3月啟用的eCTD3.1區域模板和驗證規則v8.1,對文件結構、元數據和內容完整性提出更嚴格的要求。標準引入的“追蹤表(Tracking Table)”強制校驗規則(如15.11和15.12)曾導致CEP(歐洲藥典適用性證書)遞交,后通過允許占位文件臨時解決。與早期版本相比,v8.1強化了對模塊一區域信息的邏輯驗證,并細化了對PDF書簽、超鏈接的規范性檢查。江蘇NDAeCTD推薦
- 高新區中國eCTD歡迎選購 2025-05-14
- 靜安區生物制品eCTD使用 2025-05-14
- 蕪湖新藥eCTD是什么 2025-05-14
- 吳江區賦悅科技eCTD供應商 2025-05-14
- 南京生物制品eCTD注冊系統 2025-05-14
- 上海化學藥品eCTD格式 2025-05-09
- 南京電子申報eCTD哪個品牌好 2025-05-09
- 太倉NDAeCTD服務價格 2025-05-09
- 浦東新區原料藥eCTD文件如何制作 2025-04-26
- 南京新藥eCTD找哪家 2025-04-26
- 常州儲能線束定制 2025-06-01
- 安徽自動充電機器人銷售 2025-06-01
- 江西遠程遙控機器人供應商 2025-06-01
- 國產自媒體營銷推廣怎么辦 2025-06-01
- 河南法院子母鐘品牌排行榜 2025-06-01
- 南京電力線通信芯片調制方式 2025-06-01
- 彩盒外觀檢測價位 2025-06-01
- 徐州威力智慧用電一般多少錢 2025-06-01
- 蘇州有源RFID模塊方案 2025-06-01
- 雞西品牌自媒體營銷推廣 2025-06-01